Légende :
1 : Big
Bang (il y a
13,7 milliards d’année)
2 : Inflation (séparation des
protons)
3 : Nucléosynthèse
primitive fabrication de l’hydrogène.
4 Formation des
étoiles et galaxies
2° La formation des atomes
A partir de
l’hydrogène on forme ainsi progressivement
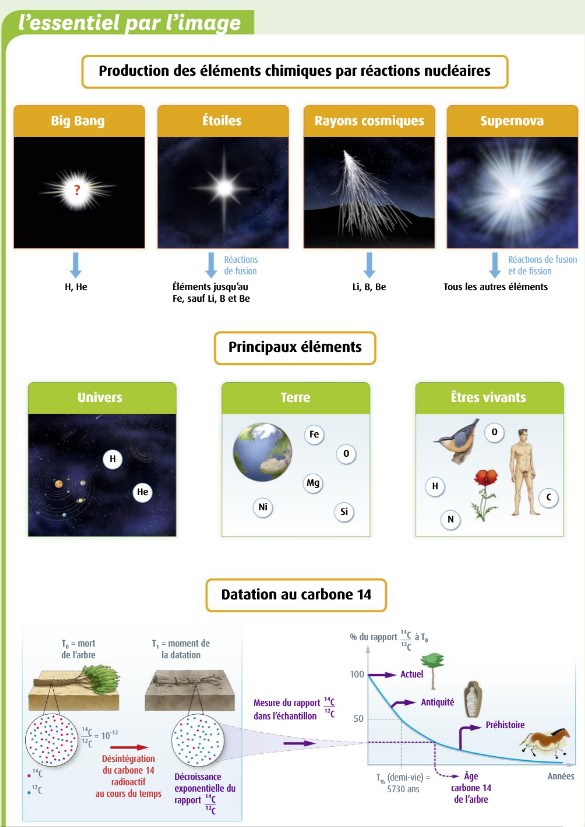
l’hélium (He), le carbone (C ) puis l’oxygène (O) et ainsi de suite jusqu’au fer (Fe).
- Dans les
étoiles, les conditions de températures sont tellement
extrêmes que les noyaux
des atomes se « collent entre eux » : C’est
la fusion nucléaire.
Définition : La fusion consiste à former de gros noyaux en réunissant des noyaux plus petits.
Inversement : Lors d’une
fission nucléaire, les noyaux se « cassent » en
noyaux plus petits.
Définition : La fission consiste à fractionner des gros noyaux pour former des noyaux plus petits
II
La radioactivité : Activité p 26
1° La radioactivité c’est naturel
2° La découverte de la radioactivité
3° Le Becquerel
4
Qu'est-ce que la radioactivité ?
- Certains noyaux produits par les supernovæ, comportent trop de neutrons par rapport au nombre
de
protons.
- Cette association est
instable. Ces
éléments se
stabilisent en éjectant des neutrons où des noyaux plus
gros. Ces désintégrations
sont aléatoires et inéluctables. Ce
phénomène s’accompagne de l’émission
d’une
particule et/ou d’un rayonnement : C’est
la radioactivité.
- Définition : La radioactivité est l’émission de particules ou de rayonnement par un noyau instable. On distingue 3 types de
radioactivité naturelle
: La radioactivité α, β et γ.
5° Conservation des particules
: Lois de Soddy
6° Equation
générale pour l’émission alpha
6° Equation
générale pour l’émission
bêta
7 Les applications
de la radioactivité : activité p 27
II
La datation
par la radioactivité : Activité p 28
- 1° Loi de
décroissance radioactive – En vidéo
- Les noyaux
radioactifs sont instables. Si on observe le nombre de noyaux
radioactifs, il diminue avec le temps. Si on observe l’activité (en Becquerel), elle diminue suivant la même loi de décroissance (dite « exponentielle ») qui finit par devenir infiniment lente. La radioactivité ne sera donc jamais totalement nulle
-
- 2° Principe de l’utilisation du carbone 14 14C pour une datation
- Le 14C
est radioactif. Le taux de carbone 14 présent dans un organisme
reste constant
tant qu’il respire car il absorbe, par
sa respiration ou l’alimentation, du carbone 14 qui est maintenu
constant dans
l’atmosphère (par l’action des rayons UV du soleil en haute
atmosphère). Son taux de carbone est donc
maintenu constant.
-
- Lorsque l’organisme cesse ses échanges avec l’atmosphère,
le taux de 14C diminue
et donc la radioactivité naturelle (en Bq) diminue.
-
- 3° Définition de la période de demi-vie d’un élément
radioactif : 3 formulations différentes
- 3.1
° A partir de l’activité :
- On appelle période de demi-vie radioactive (notée t½) le temps écoulé tel que la radioactivité (= activité en Bq) initiale
soit diminuée de moitié.
- 3.2
a)° Autre formulation à partir du nombre de noyaux radioactifs :
- On appelle
période de demi-vie radioactive (notée t½) le temps
écoulé tel que
le nombre initial de noyaux radioactifs soit diminué de moitié (=
se sont désintégrés).
- 3.2b)°
Autre
formulation à partir de la notation No correspondant au nombre
initial de
noyaux radioactifs : On appelle
période de demi-vie radioactive (notée t½) le temps
écoulé à
No/2 sur la courbe de décroissance radioactive.
-
- 4° Utilisation d’une courbe de décroissance radioactive doc 5 p 29